All’interno del progetto AGER 4F è stato affrontato il problema della sostituzione della FM con VM, PM ed IM, individuando sperimentalmente la necessità di bilanciamento aminoacidico.
A titolo di esempio, come si vede dalla figura 1, una sostituzione di FM con farina di soia comporta l’apporto degli stessi aminoacidi (AA) contenuti nella proteina di soia (SP).
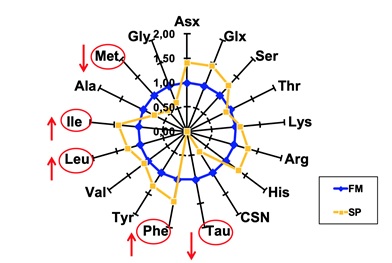
Fig. 1 – Comparazione della presenza di aminoacidi nella proteina di soia (SP) in giallo,
rispetto alla farina di pesce (FM) in blu, normalizzata uguale ad 1
A fronte di un aumento nella SP degli AA ramificati quali leucina ed isoleucina, quindi fenilalanina, istidina, arginina, serina, acido aspartico, acido glutammico, si assiste ad una carenza di aminoacidi essenziali, quali i solforati cisteina e metionina, ed una completa assenza dell’aminoacido funzionale taurina. La metionina (Met) si può integrare con addizioni dell’aminoacido di sintesi oppure di altre farine proteiche che lo contengano, ripristinando la stessa quantità presente nella FM, ottenendo la comparazione riportata in fig. 2, dove comunque risulta evidente l’assenza totale di taurina.
L’equivalenza nella presenza di Met nelle due sorgenti proteiche, dopo la dovuta integrazione, non significa comunque che l’aggiunta di Met sia completamente efficace, ovvero abbia la stessa biodisponibilità degli altri AA legati alle proteine.
Infatti, si presenta un problema di sincronismo, ossia la Met introdotta in forma di cristalli, risulta velocemente disponibile, arrivando al fegato prima degli aminoacidi proteici, non potendo pertanto contribuire alla funzione proteinogenica. Gli aminoacidi legati alle proteine, giungendo al fegato in ritardo, si troverebbero comunque in carenza di Met.
L’equivalenza nella presenza di Met nelle due sorgenti proteiche, dopo la dovuta integrazione, non significa comunque che l’aggiunta di Met sia completamente efficace, ovvero abbia la stessa biodisponibilità degli altri AA legati alle proteine.
Infatti, si presenta un problema di sincronismo, ossia la Met introdotta in forma di cristalli, risulta velocemente disponibile, arrivando al fegato prima degli aminoacidi proteici, non potendo pertanto contribuire alla funzione proteinogenica. Gli aminoacidi legati alle proteine, giungendo al fegato in ritardo, si troverebbero comunque in carenza di Met.
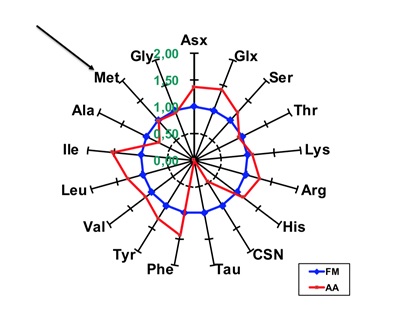
Fig. 2 - Comparazione di spettri aminoacidici come in Fig. 1,
dopo addizione di Met alla farina di soia.
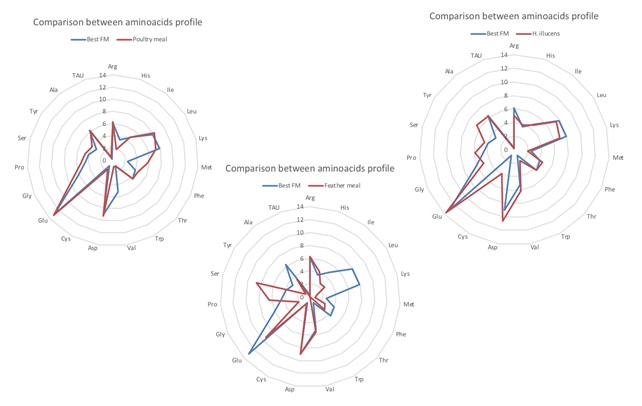
Fig. 3 – Presenza di aminoacidi nella farina di pesce (blu) con aminogrammi di altre farine (rosso),
tra le quali farina di visceri e carne di pollo (sinistra), farina di piume (al centro) e farina di larve di insetto Hermetia illucens (destra.)
Simile problema, sebbene a carico di diversi AA, lo incontriamo quando la FM viene sostituita con altre farine proteiche. In Fig. 3 è riportato l’esempio delle farine di insetti (H. illucens) e di avicoli, comparate con la farina di pesce. Per alcuni aminoacidi essenziali appare evidente la necessità di integrazioni mirate a coprire le carenze presenti in ciascuna delle farine proteiche sostitutive.
Lo stesso problema di sincronismo precedentemente descritto per la Met, si viene a presentare per tutti gli AA essenziali, per esempio per la lisina (Lys), nel caso della sostituzione di FM con farina di piume.
Ciò ha quindi reso necessario affrontare una serie di prove preliminari, finalizzate a studiare la cronologia degli AA addizionati, rispetto agli AA proteici.
Lo stesso problema di sincronismo precedentemente descritto per la Met, si viene a presentare per tutti gli AA essenziali, per esempio per la lisina (Lys), nel caso della sostituzione di FM con farina di piume.
Ciò ha quindi reso necessario affrontare una serie di prove preliminari, finalizzate a studiare la cronologia degli AA addizionati, rispetto agli AA proteici.
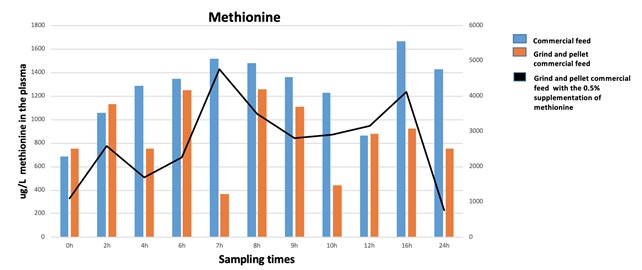
Considerando che nel mangime estruso, rispetto al semplice pellettato, gli amidi cotti possono costituire una sorta di “protezione” alla Met in cristalli, ritardandone l’assorbimento, un mangime commerciale estruso è stato sbriciolato, quindi dopo supplemento con 0,5% di Met in cristalli è stato ripellettato a freddo. Sul grafico della Fig. 3 sono riportati i risultati, in termini di concentrazione di Met nel plasma periferico di spigola (Dicentrarchus labrax), a diversi tempi dopo l’alimentazione.

Fig. 4 – Cronologia della concentrazione di Met nel plasma periferico di spigole, alimentate con:
1) mangime commerciale estruso (istogrammi blu); 2) stesso mangime sbriciolato e ripellettato a freddo (marrone);
3) mangime come in (2), ripellettato a freddo dopo aggiunta dello 0,5% di DL-Met in cristalli (linea nera).
Pur con andamenti spiegabili con l’originale addizione di Met da parte del fabbricante di mangime commerciale (blu), quindi da una possibile copertura protettiva ottenuta dopo sbriciolamento e ripellettatura (marrone), la figura mostra come effettivamente nel sangue periferico la Met addizionata si presenti con un picco a 7 ore post prandiali ed un secondo picco a 16 ore.
La prova preliminare ha pertanto confermato la necessità di un ulteriore studio sulla risposta della Met addizionata ai mangimi, comparandone forme che si suppone abbiano una diversa velocità di assorbimento. A questo scopo abbiamo comparato 4 forme di Met quali le forme L-Met e DL-Met, il dipeptide DL- Met-Met, quindi il precursore Met-idrossianalogo HTMBA, addizionate ad una formula di mangime considerato Controllo negativo (Ctr-). Le 4 formulazioni sono poi state confrontate con lo stesso mangime CTR- e con un mangime commerciale di buona qualità (CTR+). In nessuna delle formulazioni era previsto un deficit di Met, almeno per quanto riguarda gli effetti sulla crescita. Non era inoltre previsto un eccesso di Met, al fine di evitarne eventuali effetti tossici. L’ipotesi era quindi quella di verificare se forme di Met ad assorbimento ritardato, come la HTMBA e la Met-Met, fornissero eventualmente risposte differenti rispetto alla L-Met, presumibilmente assunta molto velocemente e la DL-Met che potrebbe in qualche modo subire un ritardo nel metabolismo, dovuto alla necessità di convertire la forma D-Met in L-Met. Benché la problematica relativa alla cronologia tra AA proteici ed AA addizionati sussista per tutti gli AA essenziali eventualmente addizionati, la prova è stata focalizzata sulla Met in quanto trattasi di un AA che oltre alla funzione proteogenica, ricopre un importante ruolo di AA funzionale.
Le analisi pertanto sono state condotte con la duplice finalità di verificare eventuali effetti sulle performance di crescita, sopravvivenza e conversione, quindi di studiare gli effetti funzionali, sul ciclo della Met negli organi interni.
La prova preliminare ha pertanto confermato la necessità di un ulteriore studio sulla risposta della Met addizionata ai mangimi, comparandone forme che si suppone abbiano una diversa velocità di assorbimento. A questo scopo abbiamo comparato 4 forme di Met quali le forme L-Met e DL-Met, il dipeptide DL- Met-Met, quindi il precursore Met-idrossianalogo HTMBA, addizionate ad una formula di mangime considerato Controllo negativo (Ctr-). Le 4 formulazioni sono poi state confrontate con lo stesso mangime CTR- e con un mangime commerciale di buona qualità (CTR+). In nessuna delle formulazioni era previsto un deficit di Met, almeno per quanto riguarda gli effetti sulla crescita. Non era inoltre previsto un eccesso di Met, al fine di evitarne eventuali effetti tossici. L’ipotesi era quindi quella di verificare se forme di Met ad assorbimento ritardato, come la HTMBA e la Met-Met, fornissero eventualmente risposte differenti rispetto alla L-Met, presumibilmente assunta molto velocemente e la DL-Met che potrebbe in qualche modo subire un ritardo nel metabolismo, dovuto alla necessità di convertire la forma D-Met in L-Met. Benché la problematica relativa alla cronologia tra AA proteici ed AA addizionati sussista per tutti gli AA essenziali eventualmente addizionati, la prova è stata focalizzata sulla Met in quanto trattasi di un AA che oltre alla funzione proteogenica, ricopre un importante ruolo di AA funzionale.
Le analisi pertanto sono state condotte con la duplice finalità di verificare eventuali effetti sulle performance di crescita, sopravvivenza e conversione, quindi di studiare gli effetti funzionali, sul ciclo della Met negli organi interni.
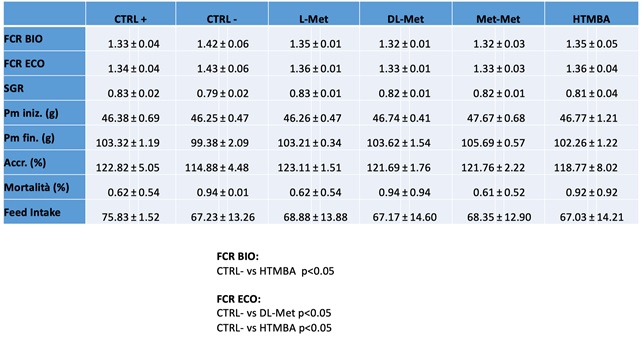
I risultati relativi alla crescita sono riportati in tabella 1, dove si può osservare come solamente il CTRL- ha mostrato performance inferiori alle varie forme di Met utilizzate, come peraltro atteso. Neanche la conversione economica ha fornito valori significativamente diversi.
Tabella 1 – Performance di spigola alimentata con mangimi addizionati con differenti forme commerciali di Met.
Tabella 1 – Performance di spigola alimentata con mangimi addizionati con differenti forme commerciali di Met.

La risposta metabolica è stata affrontata studiando l’attività trascrittomica di alcuni geni chiave del ciclo della Met, e di alcuni metaboliti intermedi. In fegato di spigola è quindi stata studiata l’attività dei geni codificanti per la betaina-omocisteina S-metiltransferasi (BHMT), cistationina-ß-sintasi (CBS), S-adenosilomocisteina Idrolasi (SAHH), quindi la presenza di due metaboliti: S-adenosil-Met (SAM) e S-adenosil-L-omocisteina (SAM) (Fig. 5).
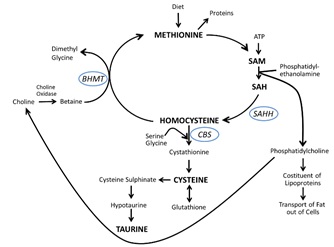
Fig. 5 – Spiegazione del ciclo della Met. Nel grafico si vedono, tra l’altro, l’assunzione di Met con la dieta, il suo ingresso nella produzione di proteine, la sintesi della taurina:1) La Met rappresenta una sorgente di zolfo, necessario per la sintesi della cisteina e della taurina, come pure è un essenziale donatore di gruppi metili nel metabolismo cellulare. Complessivamente, il 48% del metabolismo della Met proveniente dalla dieta ha luogo nel fegato; 2) Alterazioni nel metabolismo della Met possono influenzare la produzione di nutrienti essenziali per lo scheletro, per la funzione cardiovascolare e del sistema nervoso; 3) L’omocisteina è un aminoacido solforato che deriva dal metabolismo della Met. Il mantenimento dei gruppi metilici e dell’omeostasi epatica della omocisteina dipende dal bilanciamento tra S-adenosilomocisteina (SAH) ed il suo precursore S-adenosilMet (SAM), un potente inibitore delle reazioni di transmetilazione.
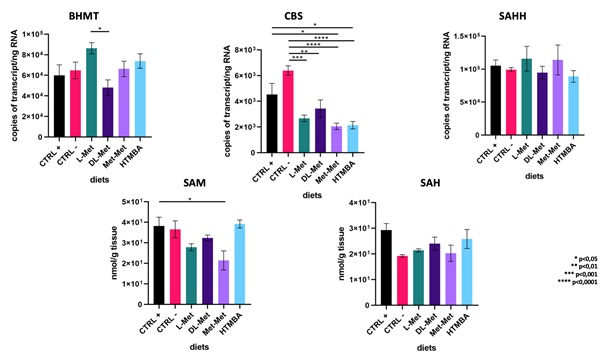
Fig. 6 – Risultati osservati dallo studio del ciclo della Met in fegato di D. labrax trattati con integrazioni di Met di diversa natura
L’interpretazione dei risultati deve essere vista nel quadro dell’omeostasi dell’omocisteina, della sintesi di cisteina e di taurina, rimetilazione della Met. La forma L-Met può essere direttamente utilizzata per la sintesi di SAM oppure essere degradata attraverso vie quali la transaminazione. La SAM a sua volta può seguire la via della transmetilazione per la sintesi di omocisteina oppure la via della transulfurazione, producendo cisteina, glutatione, taurina. Le forme D-Met, Met-Met, HTMB, presentano presumibilmente un’assimilazione più lenta, dovendo prima essere trasformate in L-Met.
Il rapporto SAM:SAH può essere influenzato dall’attività della SAHH la quale è coinvolta nell’idrolisi della SAH a omocisteina e adenosina. L’omeostasi della omocisteina dipende da fattori genetici e dall‘alimentazione (i.e. folati, vitamine B6, B12) e può essere regolata tramite la conversione di omocisteina a Met per rimetilazione oppure tramite la transizione a cisteina e taurina per trans-solforazione in reazioni richiedenti CBS. AA come la serina e glicina hanno dimostrato di alleviare la tossicità della Met incrementando la formazione di cistationina/cisteina e aumentando l'attività di CBS, la quale porta in ultimo alla rimozione dell’eccesso di omocisteina.
La rimetilazione dell’omocisteina nel fegato durante il processo di rigenerazione della Met può anche essere influenzata dai livelli di altri AA solforati presenti nella dieta, come la colina e betaina tramite aumento o diminuzione di betaina-omocisteina metiltransferasi (BHMT).
La presenza nella dieta di certi nutrienti, come gli acidi grassi polinsaturi, può influenzare l’espressione di geni coinvolti nel metabolismo della Met/omocisteina. Studi recenti suggeriscono che la dieta del pesce influenza l’attività di enzimi come CBS e BHMT, probabilmente agendo a livello di trascrizione siccome i cambiamenti dell’attività enzimatica sono spesso preceduti da un aumento o diminuzione del numero di copie di mRNA dei geni che codificano per tali enzimi.
Il rapporto SAM:SAH può essere influenzato dall’attività della SAHH la quale è coinvolta nell’idrolisi della SAH a omocisteina e adenosina. L’omeostasi della omocisteina dipende da fattori genetici e dall‘alimentazione (i.e. folati, vitamine B6, B12) e può essere regolata tramite la conversione di omocisteina a Met per rimetilazione oppure tramite la transizione a cisteina e taurina per trans-solforazione in reazioni richiedenti CBS. AA come la serina e glicina hanno dimostrato di alleviare la tossicità della Met incrementando la formazione di cistationina/cisteina e aumentando l'attività di CBS, la quale porta in ultimo alla rimozione dell’eccesso di omocisteina.
La rimetilazione dell’omocisteina nel fegato durante il processo di rigenerazione della Met può anche essere influenzata dai livelli di altri AA solforati presenti nella dieta, come la colina e betaina tramite aumento o diminuzione di betaina-omocisteina metiltransferasi (BHMT).
La presenza nella dieta di certi nutrienti, come gli acidi grassi polinsaturi, può influenzare l’espressione di geni coinvolti nel metabolismo della Met/omocisteina. Studi recenti suggeriscono che la dieta del pesce influenza l’attività di enzimi come CBS e BHMT, probabilmente agendo a livello di trascrizione siccome i cambiamenti dell’attività enzimatica sono spesso preceduti da un aumento o diminuzione del numero di copie di mRNA dei geni che codificano per tali enzimi.
Sarebbe pertanto riduttivo limitare l’interesse verso la Met alla sua funzione di aminoacido proteinogenico, visti i suoi molteplici e complessi ruoli nel metabolismo. Se da un lato lo studio ha mostrato in modo parzialmente inatteso che tutte le forme di Met utilizzate sono idonee a garantire performance di crescita e conversione, tanto da apparentemente giustificarne la scelta sulla base semplicemente dei costi, d’altro lato è evidente che una disponibilità anche “anticipata” di questo aminoacido, può modificare alcuni equilibri, per esempio il rapporto SAHH/SAH, favorendo l’incremento di omocisteina, di cui SAH è precursore. Ciò causerebbe uno sbilanciamento nei processi di trasferimento di gruppi metilici agli acidi nucleici ed alle proteine, inducendo un quadro di ipo-metiltransferasi.
In conclusione, questa sperimentazione contribuisce alle conoscenze di base sviluppate con il progetto AGER 4F, consentendo di avviare prove di crescita in azienda con parziale o totale sostituzione della farina di pesce nei mangimi.
Fonte: Marco Saroglia, Genciana Terova e Simona Rimoldi, Università degli Studi dell'Insubria














