La sua concentrazione è più elevata nei prodotti ittici piuttosto che negli animali terrestri, quindi è maggiormente presente nella farina di pesce, piuttosto che in altre farine animali, essendo praticamente assente nelle farine vegetali. L’origine della taurina è principalmente la dieta, anche se può essere sintetizzata in ambiente epatico, per conversione della cisteina mediante l’enzima cistein-acido-sulfinico-decarbossilasi.
L’informazione circa il fabbisogno nutrizionale di Tau da parte dei pesci allevati, così come sulla loro capacità biosintetica, rimane carente benché sia ormai noto che l’aggiunta di taurina ai mangimi è essenziale al fine di poter minimizzare od eliminare la farina di pesce sostituendola con altre proteine vegetali od animali.
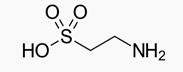
La Tau, o acido 2-amminoetanosolfonico, aminoacido non proteogenico, è un’ammina con gruppo funzionale solfonico, avente formula bruta C2H7NO3S e si presenta con la seguente formula di struttura:
La Tau, o acido 2-amminoetanosolfonico, aminoacido non proteogenico, è un’ammina con gruppo funzionale solfonico, avente formula bruta C2H7NO3S e si presenta con la seguente formula di struttura:
La Tau non è incorporata in pathway metabolici noti o nella sintesi proteica, non contribuisce alla gluconeogenesi e non rappresenta una sorgente di energia.
La Fig. 1 ne riporta lo schema di biosintesi, a partire dalla metionina o dalla cisteina:
La Fig. 1 ne riporta lo schema di biosintesi, a partire dalla metionina o dalla cisteina:
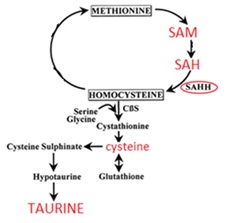
Fig. 1 – Biosintesi della taurina. Nel fegato, dalla metionina vengono prodotti due metaboliti: S-adenosil-Met (SAM) e S-adenosil-L-omocisteina (SAH).
L’idrolisi d SAH tramite l’enzima S-adenosilomocisteina Idrolasi (SAHH), genera omocisteina, la cui omeostasi epatica dipende dal bilanciamento tra SAM ed SAH. Il successivo passaggio intermedio per la biosintesi della cisteina, è la cistationina, sintetizzata enzimaticamente dall’omocisteina ad opera di cistationina-ß-sintasi (CBS). Il gruppo sulfidrilico della cisteina è a sua volta ossidato a cisteina-acido solfinico dall'enzima cisteina diossigenasi. La cisteina-acido solfinico, in seguito, è decarbossilata dalla cisteina-acido solfinico decarbossilasi per formare ipotaurina. Quest’ultima è poi ossidata a taurina, non è chiaro se spontaneamente o per via enzimatica.
I pesci sono in grado di sintetizzare una limitata quantità di Tau, tuttavia la sorgente principale rimane la dieta, tanto che mangimi carenti in Tau sono considerati critici per lo sviluppo dei pesci in allevamento intensivo. Particolare attenzione alla reale presenza di taurina biodisponibile, è perciò richiesta ogni qualvolta nel mangime la farina di pesce è sostituita con sorgenti proteiche alternative ed in special modo se si tratta di proteine vegetali. Le funzioni della Tau sono molteplici, è coinvolta in numerose funzioni fisiologiche, quali la coniugazione di sali biliari, osmoregolazione, stabilizzazione delle membrane, modulazione di neurotrasmettitori, azione antiossidante, sviluppo precoce della visione, quindi coadiuvante di importanti funzioni dei sistemi muscolare e nervoso.
Nel fegato, oltre a consentire la rimozione dei lipidici epatici, la Tau viene trasportata dai sinusoidi all’epatocita dove si coniuga con gli acidi biliari (acido colico) per essere trasformata in taurocolato. Il trasporto è facilitato principalmente da GAT2 (una proteina). Il taurocolato entra nei canalicoli biliari, quindi confluisce nell’intestino e partecipa al processo di assorbimento dei lipidi e delle vitamine liposolubili. (Fig. 2).
Nel fegato, oltre a consentire la rimozione dei lipidici epatici, la Tau viene trasportata dai sinusoidi all’epatocita dove si coniuga con gli acidi biliari (acido colico) per essere trasformata in taurocolato. Il trasporto è facilitato principalmente da GAT2 (una proteina). Il taurocolato entra nei canalicoli biliari, quindi confluisce nell’intestino e partecipa al processo di assorbimento dei lipidi e delle vitamine liposolubili. (Fig. 2).
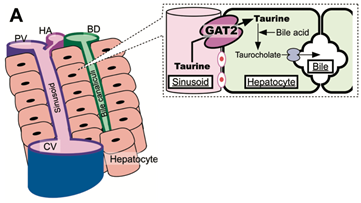
Fig. 2 – Trasporto della taurina nelle cellule epatiche. (A)Schema d’insieme. GAT2: trasportatore; CV: vena centrale; PV: vena porta; HA: vena epatica; BD: dotto biliare (Da: Kubo et al., 2016, modif.)
La Tau ricopre un indispensabile ruolo nello sviluppo del cervello, della retina e del rene, organi nei quali il transito è facilitato dalla TauT (trasportatore della Tau), una proteina molto simile alla GAT2, TauT e GAT2 fanno parte della famiglia dei trasportatori di importanti neurotrasmettitori quali la noradrenalina, la serotonina, l’acido γ-amino-butirrico (GABA) e sono Na+- Cl- dipendenti. Nella retina Tau gioca un importante ruolo come antiossidante e come osmolita (controllo della pressione osmotica). TauT avrebbe il ruolo di facilitare il trasporto della Tau dai capillari alla retina, attraverso la barriera emato-retinica (blood-retinal barrier, BRB) e contemporaneamente il GABA dalla retina al circuito ematico (Fig. 3).
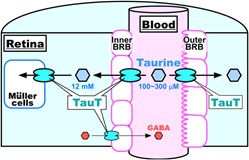
Fig. 3 – Trasporto della Tau dal sangue alla retina e del GABA in senso inverso, ruolo del trasportatore TauT. Le cellule del Müller costituiscono un sito di accumulo di Tau (Da: Kubo et al., 2016, modif.).
Una disponibilità di Tau eccedente rispetto al fabbisogno viene eliminata per via renale, mentre lo stesso rene opera un riassorbimento nei tubuli contorti distali, quando l’organismo è in deficienza. La regolazione, come si vede dallo schema di fig. 4, avviene ad opera di TauT ed il trasporto della taurina avviene simultaneamente al trasporto di uno ione Cl- e 2 ioni Na+.
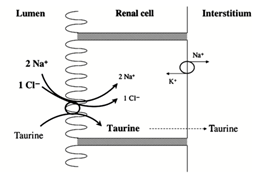
Fig. 4 – Sistema del trasportatore 2Na+:1Cl-:1Tau nelle cellule tubulari prossimali del rene
All’interno del progetto AGER 4F è stato affrontato il problema del fabbisogno di Tau in trota iridea ed in spigola, con differente tipologia di approfondimento sperimentale.
- Sperimentazione su trota iridea
Trote iridee sono state alimentate con mangime commerciale formulato con una importante base di farina di pesce (Ctr+), con farina di pesce sostituita da proteine vegetali senza arricchimento in Tau (Ctr-), quindi formulazioni che avevano come base la stessa della dieta Ctr-, alle quali sono state addizionate rispettivamente 0,25%; 0,5%; 1,0% di taurina (Tau 0,25; Tau 0,5; Tau 1,0) (Tab. 1).
Trote iridee sono state alimentate con mangime commerciale formulato con una importante base di farina di pesce (Ctr+), con farina di pesce sostituita da proteine vegetali senza arricchimento in Tau (Ctr-), quindi formulazioni che avevano come base la stessa della dieta Ctr-, alle quali sono state addizionate rispettivamente 0,25%; 0,5%; 1,0% di taurina (Tau 0,25; Tau 0,5; Tau 1,0) (Tab. 1).
Tab. 1 – Risposta di trota iridea a diete con differenti contenuti di taurina. Sulla prima colonna sono riportati: peso iniziale (IBW), peso finale (FBW), guadagno in biomassa (WG), fattore di conversione (FCR), efficienza proteica (protein efficiency ratio, PER), incremento di crescita standard (SGR)
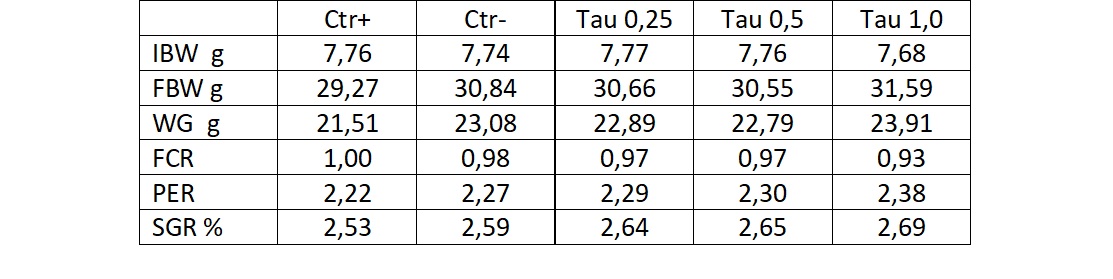
I valori di crescita (SGR%, FBW), pur non sempre statisticamente significativi nelle differenze, mostrano un chiaro trend in salita correlato con la concentrazione di Tau. Il trend è poi confermato dai valori di FCR e di PER che per Tau 1,0 dimostrano un importante incremento nell’efficienza della conversione e dell’uso della proteina.
L’attività trascrittomica del gene che sintetizza per TauT è inoltre stata da noi monitorata nel tentativo di spiegare la dose ottimale di taurina nel mangime. I dati della figura 5 consentono di individuare come con Tau 1,0 a livello epatico la TauT sia ridotta rispetto alle inclusioni inferiori, lasciando ipotizzare un sufficiente trasporto operato da altri trasportatori quali GLUT2 che nel fegato sembrerebbe essere preferenziale, o per gradiente. Contestualmente, a livello renale, anche la concentrazione più elevata corrispondente a Tau 1,0 non attiva a livello renale una maggiore domanda di TauT, lasciando ipotizzare che la concentrazione di 1 mg/kg di mangime rappresenti un livello di inclusione tale da richiedere ancora il riassorbimento dai tubuli contorti distali.
L’attività trascrittomica del gene che sintetizza per TauT è inoltre stata da noi monitorata nel tentativo di spiegare la dose ottimale di taurina nel mangime. I dati della figura 5 consentono di individuare come con Tau 1,0 a livello epatico la TauT sia ridotta rispetto alle inclusioni inferiori, lasciando ipotizzare un sufficiente trasporto operato da altri trasportatori quali GLUT2 che nel fegato sembrerebbe essere preferenziale, o per gradiente. Contestualmente, a livello renale, anche la concentrazione più elevata corrispondente a Tau 1,0 non attiva a livello renale una maggiore domanda di TauT, lasciando ipotizzare che la concentrazione di 1 mg/kg di mangime rappresenti un livello di inclusione tale da richiedere ancora il riassorbimento dai tubuli contorti distali.
A)
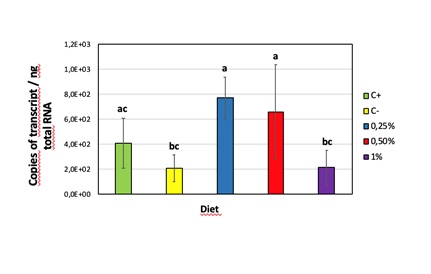
B)
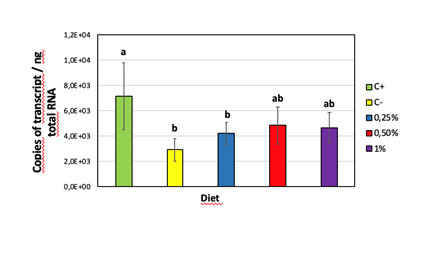
Fig. 5 – Attività del gene trasportatore della taurina (TauT) in trota alimentata con differenti livelli di Tau nel mangime: A) in fegato; B) in rene.
- Sperimentazione su spigola (Rif: Ceccotti et al., Animals 2019, 9, 607; doi:10.3390/ani9090607)
Al fine di valutare quanto condizioni ambientali possano interferire sul fabbisogno di taurina, e contestualmente verificare il ruolo di “scavanger” dei radicali liberi della Tau stessa, abbiamo condotto una sperimentazione su spigole sottoposte ad uno stress controllato mediante nuoto forzato fino al limite delle performance dei singoli animali, ciascuno dei quali era contrassegnato (taggato) con strisce di plastica, in modo da poter essere individualmente riconoscibile. E’ noto che l’attività fisica è causa produzione di radicali liberi (ROS, Reactive Oxygen Species) da parte dei leucociti che vengono liberati nel sangue circolante (Respiratory Burst). A questo proposito, un’unica popolazione di spigole era stata prima alimentata con mangime commerciale basato su proteine da farina di pesce. Raggiunta una taglia media di 92,5g, la popolazione era divisa casualmente in due gruppi, Ctr e Tau. Ciascuno dei gruppi era alimentato con mangime contenente 45% di proteina grezza a base vegetale, dove la farina di pesce era limitata al 15%. Solamente la popolazione Tau riceveva nello stesso mangime un’inclusione di taurina pari all’ 1,5%. Dopo successivo periodo di acclimatazione alla dieta, ciascun pesce era successivamente sottoposto a nuoto con incrementi progressivi di velocità del flusso di acqua, fino a raggiungere una velocità critica come performance individuale (Ucrit), definita poi in termini di cm/sec, poi normalizzati bl/sec (lunghezza del corpo/sec). I ROS prodotti dai leucociti erano titolati a partire da un campione di sangue caudale prima delle prove di nuoto, quindi al termine di ciascuna delle due prove cui ciascun pesce era sottoposto, rispettando 20 giorni di riposo tra la prima e la seconda prova. Su campioni di fegato e di muscolo rosso è stata titolata l’attività trascrittomica di geni che codificano per alcuni enzimi quali Superossido Dismutasi (SOD), Catalasi (CAT) e Glutatione Perossidasi (GPX). In particolare SOD rimuove i pericolosi ROS dalla cellula, catalizzando la trasformazione del radicale superossido in perossido d’idrogeno (H2O2) od in ossigeno molecolare (O2), CAT catalizza la trasformazione di H2O2 in H2O ed O2, mentre GPX decompone i perossidi.

Fig. 6 – Vista del tunnel di nuoto. A titolo di esempio dimostrativo, un esemplare di C. auratus evidenzia il settore del tunnel dedicato alla camera di nuoto.
Tab. 2 – Risposta delle spigole con alimentazione differenziata e nella camera di nuoto. MO2: consumo metabolico di ossigeno in mg/kg/hr; Ucrit: velocità di nuoto critica, espressa in bl/sec; SGR%: incremento giornaliero di biomassa.
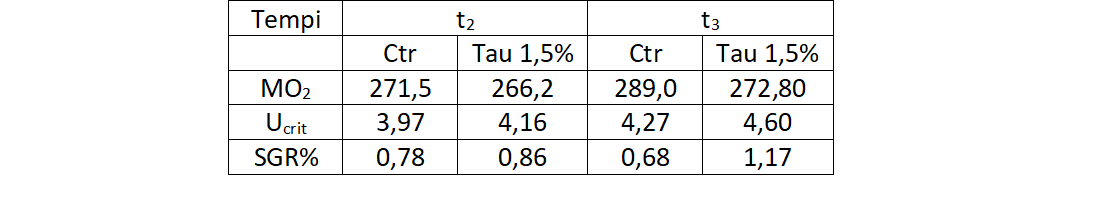
In Tab. 2, le performance metaboliche indicano un minore dispendio energetico nei pesci alimentati con Tau 1,5%, con corrispondenti migliori performance di nuoto, espresse in lunghezze/sec (bl/sec). Sebbene la sperimentazione di 60giorni non sia stata sufficientemente lunga per valutare correttamente le performace di crescita, è comunque evidente un significativo vantaggio osservato tra la popolazione alimentata con Tau 1,5%.
Dal grafico della fig. 7 si può osservare come l’inclusione del 1,5% di Tau in un mangime su base prevalentemente vegetale sia tale da evidenziare, anche a riposo (t1), l’attività di scavanger della Tau. Nei pesci sottoposti a stress di nuoto forzato, nei quali il Respiratory Burst dei leucociti è evidentemente incrementato in entrambi i gruppi, si osserva poi come Tau eserciti una notevole protezione verso i radicali liberi prodotti dal Respiratory Burst dei leucociti (t2;t3). Anche la risposta trascrittomica di geni che codificano nel muscolo rosso e nel fegato per SOD, CAT e GPX ha evidenziato una significativa differenza tra i due gruppi, con una maggiore attività in quelli alimentati con Tau 1,5%.
È pertanto evidente il ruolo della Tau a difesa contro i radicali liberi e della risposta immunitaria innata dei pesci a riposo, protezione che si rivela poi molto più importante quando gli animali sono in attività o sottoposti a stress.
Dal grafico della fig. 7 si può osservare come l’inclusione del 1,5% di Tau in un mangime su base prevalentemente vegetale sia tale da evidenziare, anche a riposo (t1), l’attività di scavanger della Tau. Nei pesci sottoposti a stress di nuoto forzato, nei quali il Respiratory Burst dei leucociti è evidentemente incrementato in entrambi i gruppi, si osserva poi come Tau eserciti una notevole protezione verso i radicali liberi prodotti dal Respiratory Burst dei leucociti (t2;t3). Anche la risposta trascrittomica di geni che codificano nel muscolo rosso e nel fegato per SOD, CAT e GPX ha evidenziato una significativa differenza tra i due gruppi, con una maggiore attività in quelli alimentati con Tau 1,5%.
È pertanto evidente il ruolo della Tau a difesa contro i radicali liberi e della risposta immunitaria innata dei pesci a riposo, protezione che si rivela poi molto più importante quando gli animali sono in attività o sottoposti a stress.
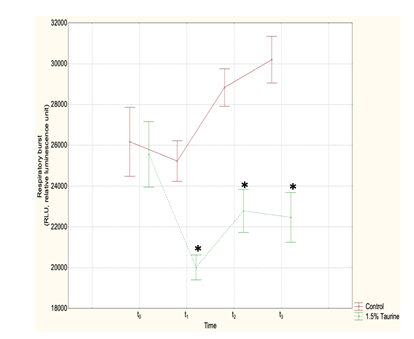
Fig. 7 – Misura della luminosità da Respiratory Burst in spigole sottoposte a nuoto forzato a differenti tempi riportati sull’asse delle ascisse: t0: popolazione originale in acclimatazione, prima di ricevere alimentazioni differenziate; t0: alimentazione uguale; t1: pesci che ricevono alimentazioni differenziate, ancora a riposo; t2: immediatamente dopo la prima prova di nuoto; t3: al termine della seconda prova di nuoto. Sulle ordinate, i quanti di luce prodotti sono proporzionali alla presenza di ROS. Nel grafico, ciascun punto rappresenta la media delle risposte individuali di 10 pesci. In rosso: gruppo Ctr; in verde: gruppo Tau.
In conclusione, benché la sperimentazione condotta sulla trota abbia evidenziato come apparentemente sufficiente un’inclusione di 1,0% di Tau nel mangime, al fine di garantire le normali performance di crescita e di conversione, il successivo approfondimento sugli effetti antiossidanti e sulle performance della spigola indicano come un incremento dell’inclusione della Tau fino al valore di 1,5% consenta ulteriori effetti benefici al pesce in allevamento intensivo. È lecito supporre che tali effetti benefici possano ampiamente compensare il maggiore costo dovuto all’inclusione della taurina, ancor più nel caso di ulteriore riduzione della componente in farina di pesce.
In conclusione, questa sperimentazione contribuisce alle conoscenze di base sviluppate con il progetto AGER 4F, consentendo di avviare prove di crescita in azienda con parziale o totale sostituzione della farina di pesce nei mangimi.
In conclusione, questa sperimentazione contribuisce alle conoscenze di base sviluppate con il progetto AGER 4F, consentendo di avviare prove di crescita in azienda con parziale o totale sostituzione della farina di pesce nei mangimi.
Fonte: Marco Saroglia, Genciana Terova, Simona Rimoldi, Micaela Antonini, Ilaria Biasato e Laura Gasco














