La sua concentrazione è più elevata nei prodotti ittici piuttosto che negli animali terrestri, quindi è maggiormente presente nella farina di pesce, piuttosto che in altre farine animali ed è assente nelle farine proteiche vegetali. L’origine della Tau è principalmente la dieta, anche se può essere sintetizzata nel fegato, per conversione di aminoacidi solforati quali cisteina, a sua volta derivante dalla metionina.
L’informazione circa il fabbisogno nutrizionale di Tau da parte dei pesci allevati, così come sulla loro capacità biosintetica, rimane carente benché sia ormai noto che l’aggiunta di Tau ai mangimi è essenziale al fine di poter minimizzare od eliminare la farina di pesce sostituendola con altre proteine vegetali od animali.
I pesci sono in grado di sintetizzare una limitata quantità di Tau, tuttavia la sua sorgente principale rimane la dieta, tanto che mangimi carenti in Tau sono considerati critici per lo sviluppo dei pesci in allevamento intensivo. Particolare attenzione alla reale presenza di Tau biodisponibile, è perciò richiesta ogni qualvolta nel mangime la farina di pesce è sostituita con sorgenti proteiche alternative ed in special modo se si tratta di proteine vegetali.
Le funzioni della Tau sono molteplici, è coinvolta in numerose funzioni fisiologiche, quali la coniugazione di sali biliari, lo sviluppo della visione, osmoregolazione, stabilizzazione delle membrane, modulazione di neurotrasmettitori, azione antiossidante, quindi coadiuvante di importanti funzioni dei sistemi muscolare e nervoso.
La Tau ricopre un indispensabile ruolo nello sviluppo del cervello, della retina e del rene, organi nei quali il suo transito è facilitato dalla TauT (trasportatore della Tau), una proteina facente parte della famiglia dei trasportatori di importanti neurotrasmettitori quali la noradrenalina e la serotonina, . Nella retina Tau gioca un importante ruolo come antiossidante e come osmolita (controllo della pressione osmotica).
Una disponibilità di Tau eccedente rispetto al fabbisogno viene eliminata per via renale, mentre lo stesso rene opera un riassorbimento quando l’organismo è in deficienza. La regolazione avviene ad opera di TauT ed il trasporto della Tau è simultaneo al trasporto di uno ione Cl- e 2 ioni Na+.
All’interno del progetto AGER 4F è stato affrontato il problema del fabbisogno di Tau in trota iridea ed in spigola, con differente tipologia di approfondimento sperimentale.
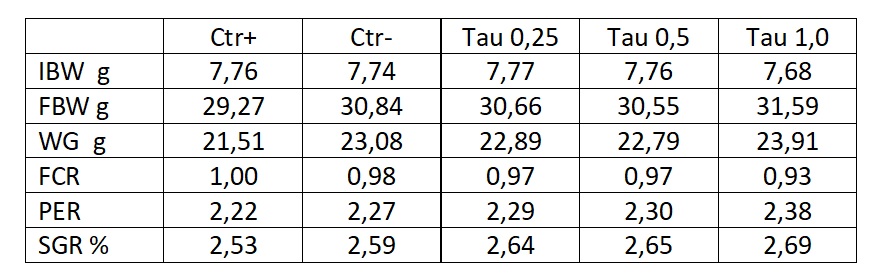
Trote iridee sono state alimentate con mangime commerciale formulato con una importante base di farina di pesce (Ctr+), con farina di pesce sostituita da proteine vegetali senza arricchimento in Tau (Ctr-), quindi formulazioni che avevano come base la stessa della dieta Ctr-, alle quali sono state addizionate rispettivamente 0,25%; 0,5%; 1,0% di Tau (Tau 0,25; Tau 0,5; Tau 1,0) (Fig. 1).
Fig. 1 – Sostituzione della farina di pesce nei mangimi per trota. Studi per il bilanciamento degli aminoacidi (Metionina, taurina), presso il Centro di Allevamento Sperimentale di UNITO sito a Carmagnola (Torino).
I descrittori della crescita (SGR%) e la biomassa totale sono risultati via via più elevati con l’incremento di Tau nella dieta e lo stesso effetto benefico è stato confermato per la conversione (FCR) e per l’efficienza proteica (PER), proporzionalmente all’aumento di Tau nella dieta, fino al valore di 1,0% (Tab. 1). Utilizzando una piattaforma molecolare, è stata monitorata l’attività trascrittomica del gene che codifica per il trasportatore della Tau nel fegato e nel rene (TauT). Dallo studio si ricava che 1,0% di Tau nel mangime per trota consente una condizione normale di crescita, senza che gli indicatori molecolari suggeriscano un eccesso.
Tab. 1 – Risposta di trota iridea a diete con differenti contenuti di Tau. Sulla prima colonna sono riportati: peso iniziale (IBW),
peso finale (FBW), guadagno in biomassa (WG), fattore di conversione (FCR), efficienza proteica (protein efficiency ratio, PER), incremento di crescita standard (SGR)
Al fine di valutare quanto le condizioni ambientali possano interferire sul fabbisogno di Tau, e contestualmente verificare il ruolo di “scavanger” dei radicali liberi della Tau stessa, è stato condotto uno studio sulla spigola, i cui risultati sono stati recentemente pubblicati (C. Ceccotti, B. Al-Sulaivany, O. Al-Habbib , M.Saroglia, S. Rimoldi e G. Terova, 2019, Animals, 9, 607; doi:10.3390/ani9090607). Le spigole sono state sottoposte ad uno stress controllato mediante nuoto forzato (Fig. 2), fino al limite delle performance dei singoli animali, ciascuno dei quali era riconoscibile individualmente, in quanto contrassegnato con strisce di plastica colorate. È noto che l’attività fisica causa produzione di radicali liberi (ROS, Reactive Oxygen Species) da parte dei leucociti che vengono liberati nel sangue circolante (Respiratory Burst). A questo proposito, una popolazione di spigole è stata divisa in due gruppi, entrambi alimentati con mangime a base di proteina vegetale in elevata percentuale. Il mangime di uno dei due gruppi, pur mantenuto isoproteico ed isoenergetico, è stato arricchito con 1,5% di Tau. Dopo successivo periodo di acclimatazione alla nuova dieta, ciascun pesce a turno era sottoposto a nuoto con incrementi progressivi di velocità del flusso di acqua, fino a raggiungere una velocità critica come performance individuale, in termini di cm/sec, poi normalizzati bl/sec (lunghezza del corpo/sec). I radicali liberi prodotti dai leucociti erano titolati a partire da un campione di sangue caudale prima delle prove di nuoto, quindi al termine di ciascuna delle due prove cui ciascun pesce era sottoposto, rispettando 20 giorni di riposo tra la prima e la seconda prova. Su campioni di fegato e di muscolo rosso è stata titolata l’attività trascrittomica di geni che codificano per alcuni enzimi che degradano i radicali liberi.

Fig. 2 – Vista del tunnel di nuoto presso la Stazione Pilota dell’Università dell’Insubria a Varese. Per definire meglio la camera di nuoto con colore, nell’esempio è stato introdotto un esemplare di Carassius auratus.
Le performance metaboliche osservate indicano un minore dispendio energetico nei pesci alimentati con Tau 1,5%, con corrispondenti migliori performance di nuoto, espresse in lunghezze/sec (bl/sec). Sebbene la sperimentazione di 60 giorni non sia stata sufficientemente lunga per valutare correttamente le performance di crescita, è comunque evidente un significativo vantaggio osservato tra la popolazione alimentata con Tau 1,5%. Dal grafico della fig. 3 si può osservare come l’inclusione del 1,5% di Tau in un mangime su base prevalentemente vegetale sia tale da evidenziare, anche a riposo (t1), l’attività di scavanger della Tau. Nei pesci sottoposti a stress di nuoto forzato, nei quali il Respiratory Burst dei leucociti è evidentemente incrementato in entrambi i gruppi, si osserva poi come Tau eserciti una notevole protezione verso i radicali liberi (t2; t3). (Fig. 3). È pertanto evidente il ruolo della Tau a difesa contro i radicali liberi e della risposta immunitaria innata dei pesci a riposo, protezione che si rivela poi molto più importante quando gli animali sono in attività o sottoposti a stress.
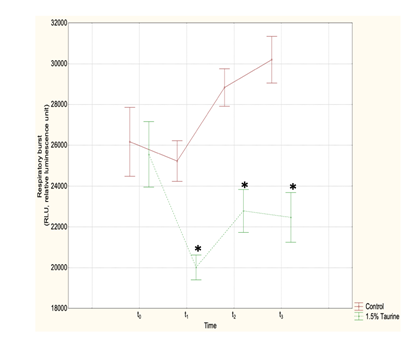
Fig. 3 – Misura del Respiratory Burst in spigole sottoposte a nuoto forzato a differenti tempi riportati sull’asse delle ascisse: t0: popolazione originale in acclimatazione, prima di ricevere alimentazioni differenziate; t1: pesci che ricevono alimentazioni differenziate, ancora a riposo; t2: immediatamente dopo la prima prova di nuoto; t3: al termine della seconda prova di nuoto. Sulle ordinate, i quanti di luce prodotti sono proporzionali alla presenza di ROS. Nel grafico, ciascun punto rappresenta la media delle risposte individuali di 10 pesci. In rosso: gruppo Ctr; in verde: gruppo Tau.
Benché la sperimentazione condotta sulla trota abbia evidenziato come apparentemente sufficiente un’inclusione di 1,0% di Tau nel mangime, al fine di garantire le normali performance di crescita e di conversione, il successivo approfondimento sugli effetti antiossidanti e sulle performance della spigola in attività di nuoto, indicano come un incremento dell’inclusione della Tau fino al valore di 1,5% consenta ulteriori effetti benefici al pesce in allevamento intensivo. È lecito supporre che tali effetti benefici possano ampiamente compensare il maggiore costo dovuto all’inclusione della Tau, ancor più nel caso di ulteriore riduzione della componente in farina di pesce. In conclusione, sebbene l’attuale contingenza sanitaria che sta bloccando gli spostamenti outdoor ed il raggruppamento di persone attorno alle strutture sperimentali abbia sensibilmente rallentato la sperimentazione, essa non ha affatto subìto alcuna battuta di arresto ma è proseguita sebbene con modalità diverse, pur in ottemperanza ai decreti della Presidenza del Consiglio dei Ministri emanati nei mesi di marzo ed aprile 2020.

Fig. 4 – La ricerca AGER 4F ai tempi del COVID-19
I gruppi di lavoro che fanno capo al progetto AGER 4F sono ora pronti a raccogliere i risultati di sperimentazioni che già precedentemente avviate, sono proseguite per il mantenimento degli animali secondo il disegno sperimentale e sono ora mature per la raccolta di campioni da avviare a successive analisi di laboratorio. La sperimentazione in scala aziendale, finalizzata a testare anche in chiave economica mangimi con sostituzione quasi totale della farina di pesce, potrà quindi essere riavviata non appena sarà possibile farlo nel rispetto dei criteri di sicurezza per le persone. I risultati già ottenuti dagli studi preliminari, inclusi quelli sul riequilibrio degli aminoacidi, consentono infatti di formulare mangimi alternativi che l’industria potrà decidere di produrre migliorando la sostenibilità dell’acquacoltura, salvaguardando le risorse oceaniche e la qualità delle acque, pur mantenendo la qualità e la sicurezza del prodotto finale, oltre al benessere nutrizionale dei pesci.




















